
Главная |
|||||||||||||||||||||||||||||||||||||||||
"О тушении пожаров морской водой."А. Ершов
|
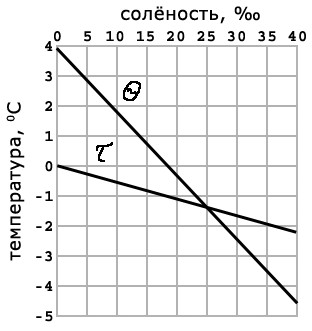 |
| Рис. 63. График зависимости между температурой замерзания - и температурой наибольшей плотности - |
В простейшем случае "...Если бы морская вода содержала в растворе одну только какую-нибудь соль, то соленость морского льда (а отсюда и количество оставшейся в растворе соли) определялось бы только двумя факторами-концентрацией раствора (морской воды) и скоростью образования льда. Вода при своем охлаждении, достигнув так называемой эвтектической точки, превратилась бы в лед, содержащий совершенно определенное количество этой соли, получился бы криогидрат, или смесь определенного содержания воды в твердом виде и соли, обладающая определенной температурой плавления, и сколько бы мы дальше ни понижали температуру, смесь (криогидрат) осталась бы без изменения.
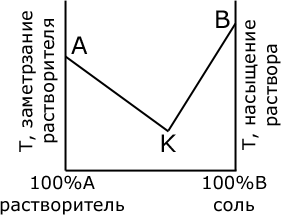 |
| Рис. 64. Эвтектическая кривая. |
Это явление подчиняется правилу фаз и может быть выражено графически следующим образом (рис. 64). Диаграмма имеет общее значение. По горизонтальной оси этой комбинированной диаграммы наносим содержание обоих компонентов, начиная от 100% того и другого; слева, в точке А будем иметь чистый растворитель (в нашем случае вода), справа, начиная от точки В, чистую соль. По вертикальной оси расположены температуры замерзания растворителя (слева) и насыщения раствора данной солью (справа). Если мы станем охлаждать водный раствор соли, то начнет выкристаллизовываться вода, и в растворе от этого возрастет количество оставшейся соли. Левая кривая (замерзания) с увеличением концентрации оставшегося раствора пойдет поэтому вниз. Дальнейшее охлаждение вызовет замерзание новой порции воды и увеличение концентрации раствора и т. д. до пересечения с правой кривой. Правая кривая (растворимости) выражает зависимость между температурой и насыщением раствора солью. Кривая показывает, что по мере охлаждения раствора, взятого из первоначально слабого раствора (каковым является морская вода как раствор ненасыщенный), растворимость соли будет падать (правая кривая идет книзу) до тех пор, пока она не пересечет кривую замерзания в точке К (криогидратная точка, точка эвтектики).
Точка К отвечает температуре насыщения раствора. Попытаемся понизить температуру еще дальше. В таком случае выделится некоторое количество льда, но от этого раствор станет более концентрированным, пересыщенным, и начнет выделяться соль до тех пор, пока не останется в растворе то количество соли, которое требуется для насыщения при этой температуре. Дальнейшее охлаждение приведет только к увеличению количества криогидрата, и весь раствор затвердеет в однородную смесь. Раствор, достигший состава, отвечающего точке пересечения кривой, ведет себя как чистая жидкость и имеет определенную температуру замерзания. Отсюда следует, что, если взять раствор, по своей концентрации отвечающий концентрации при точке К, то по мере охлаждения его не будет выделяться ни лед, ни соль.
Здесь мы рассмотрели простейший случай, когда в растворе имеется только одна соль."
В реальной ситуации "морская же вода, как мы знаем, представляет раствор сложного состава, и каждая соль, входящая в ее состав, обладает своей эвтектической температурой, как это видно из нижеприведенных данных.
| Сернокислый натрий | при -0,7° |
| Хлористый калий | при -11,1° |
| Хлористый натрий | при -21,9° |
| Хлористый магний | при -33,6° |
| Хлористый кальций | при -55,0° |
Однако еще раньше глауберовой соли выделяется из морской воды карбонат кальция, из чего можно заключить, что морская вода почти насыщена этой солью.
То обстоятельство, что состав морской воды сложен, приводит к смещению эвтектических температур, и таким образом, например, глауберова соль выделяется не при-0,7°, как это имеет место в случае простого раствора этой соли в воде, а при-8,2°. При дальнейшем понижении температуры сульфаты продолжают выделяться сначала быстро, а затем медленнее; в результате этого избирательного свойства морской воды при замерзании выделять из раствора раньше сульфаты (Петерссон) состав незамерзшей еще воды должен меняться в сторону обогащения ее другими солями, и в частности хлоридами; поэтому состав солей во льду должен отличаться относительным преобладанием сульфатов. … Одним из важных факторов, влияющих на соленость льда, является скорость образования его, которая в свою очередь зависит от температуры: чем ниже температура, тем быстрее замерзает вода и поэтому между кристаллами льда остается больше морской воды. В процессе образования льда, выделение солей носит избирательный характер.
Процесс льдообразования представляет собой довольно сложное явление. Необходимым условием начала кристаллизации воды является переохлаждение. Начавшаяся кристаллизация в отдельных центрах выражается в образовании призматических или плоских кристаллов гексагональной системы, которые, срастаясь постепенно, образуют тонкий слой лежащей на поверхности воды ("ледяное сало"). Дальнейшее нарастание льда выражается в том, что пластинки кристаллов льда располагаются вертикально и по этому строению легко отличить морской лед от других видов льда".
2. Состав солей, растворенных в морской воде, выраженный в весовых единицах (в граммах) и в процентах ко всей солевой массе (усредненные данные по Мировому океану.)
| г/1000г воды | % | |
| Хлористый натрий (NaCl) | 27,213 | 77,758 |
| Хлористый магний (MgCl2) | 3'07 | 10,878 |
| Сернокислый магний (MgS04) | 1,658 | 4,737 |
| Сернокислый кальций (CaS04) | 1,260 | 3,600 |
| Сернокислый калий (K2S04) | 0,863 | 2,465 |
| Углекислый кальций (СаСО3) | 0,123 | 0,345 |
| Бромистый магний (MgBr2) | 0,076 | 0,217 |
| ИТОГО: | 35,000 | 100,000 |
"Снабтехиздат", Москва - Ленинград, 1935 г., с35
Следует учесть, что в холодных морях Мирового океана соленость воды ниже средней, а в теплых - выше
3. Справка по климатическим условиям в районе Охотского моря.
"Охотское море, часть Великого океана, на Северо-востоке Азии, с С. ограничено материком (Приморск. обл.), на востоке - полуостровом Камчаткой, на юго-востоке и Ю.-о-вами Курильск. и Йессо (Япония), на западе - островом Сахалином. Поверхность около 1,5 милл. кв. км. Полярный климат; море вскрывается ото льда в мае, а замерзает в октябре, хотя, вероятно, замерзает не сплошь; льды плавают все лето.
Поверхностная охотская вода занимает слой глубиной до 300-500 м и за исключением прибрежной зоны наблюдается на всём пространстве моря. Её температура зимой от - 1,8 до 2° С, летом от - 1,5 до 15° С, солёность от 32,8 до 33,8‰.
Леонов А. К., Региональная океанография, ч. 1, Л., 1960.
Какие же зимние температуры мы выберем как базовые для нашего исследования? Охотское море протянулось с севера на юг больше чем на 1000 км. В условиях задачи Алексей Васильевич говорит, что дело происходит в Заполярье. Строго говоря, Охотское море в Заполярье не находится. Его самая крайняя точка, если брать за нее даже не само море, а входящую в один из заливов Пенженскую губу, не выходит на север далее 63 параллели. (Заполярье - это та местность, которая находится за полярным кругом, в более высоких широтах. Полярные круги - параллели соответственно с северной (Северный полярный круг) и южной (Южный полярный круг) широтой около 66.5 градуса). Будем считать, что речь идет о Магадане - крупном северном порте Охотского моря.
Север Охотского моря:
"Магаданская область ... По своему географическому положению она относится к районам Крайнего Севера и характеризуется суровым климатом, значительной удаленностью территории от центральных районов страны. Более половины площади омывается водами Охотского моря. Климат береговой части территории смягчается влиянием океана: зимой температура не бывает ниже -40 градусов, а летом только в отдельные дни превышает +20. В континентальной части климат более резкий, в зимний период морозы в глубине материка, как говорят здесь, "на трассе", подолгу держатся на отметке -50 и ниже."
Итак, условия работы системы пожаротушения определены. Ясны и характеристики растворов, которые предполагается использовать.
4. Экспериментальная проверка.
Нами была поставлена серия опытов по замораживанию морской воды и концентрированных растворов на ее основе.
Опыт №1:
Был изготовлен 30% раствор морских солей (без ароматизаторов), купленных в аптеке. Данная концентрация примерно в 10 раз превышает концентрацию солей в морской воде северных морей.Полученный раствор был поставлен в накрытой крышкой двухлитровой емкости в морозильную камеру бытового холодильника, где выдерживался при температуре -18 градусов по Цельсию в течение 26 часов. Уже через час на дне можно было наблюдать рыхлый осадок. По прошествии 26 часов раствор не застыл, но на стенках высел слой соли в виде конгломератов, хрустевший при надавливании. Вязкость раствора заметно увеличилась.
Если посмотреть диаграмму, приведенную ранее в комментарии, то можно увидеть, что исходная концентрация соответствует полю растворенного вещества в случае бинарной смеси. То есть при достижении температуры начала кристаллизации должно начаться выпадение солей из раствора. Что и произошло.
Опыт № 2:
Был взят 15 -процентный раствор по соли. При упрощенном подходе и рассмотрении этого процесса опять-таки в виде бинарной смеси вода - соль можно сказать, что теперь мы работаем в поле растворителя, то есть воды.
Через 10 часов охлаждения при - 18 градусов по Цельсию на стенках емкости образовалось ледяное кольцо толщиной примерно 50 мм. Лед рыхлый, пронизан хаотично расположенными белыми "иглами". Центральная часть емкости была заполнена незамерзшим раствором.
Опыт № 3:
Был взят 4 - процентный раствор тех же солей. Через 1,5 часа после начала замораживания при -18 градусов по Цельсию раствор замерз весь.
По результатам всех трех опытов надо заметить, что они были чисто качественными, не преследовали целью получить количественные результаты или зависимости.
5. Иные возможности.
Итак, теория предсказывает (и проведенные опыты это подтверждают) что любые растворы морской воды замерзают при температурах, обычных для зимних условий Крайнего Севера. Нет ли иных вариантов для реализации предложенной идеи - "просто увеличивать концентрацию соли в растворе"?
Такой вариант есть. Рекордсменом по хладостойкости водных растворов неорганических веществ является насыщенный раствор (29,4%) хлористого кальция (далее ХК). Температура замерзания такого раствора составляет по разным источникам от -49 до - 55 градус по Цельсию. Однако в промышленности его редко используют при температурах ниже - 45. Объясняется это тем, что давление насыщенных паров над ХК крайне мало и он активно впитывает влагу из окружающей среды. А в зоне температур -45…-55 изменение концентрации воды даже на 0,1% может привести к не управляемому пользователем системы замерзанию раствора
6. Растворы солей и коррозия.
Известно, что морская вода - это сильный коррозионный агент. Увеличение концентрации солей приводит к многократному усилению коррозии. Особенно сильно сказывается разъедающее действие морской воды на задвижках, датчиках, системах распыления, насосах.
В книге Богорад И.А., Искра Е.В. и др. "Коррозия и защита морских судов" Судостроение, Ленинград, 1973 год, приведены данные по средней скорости коррозии в морской воде корпуса корабля из углеродистой стали, которая составляет - 0,7 - 1,15 мм/год.
В том же источнике указывается, что срок службы судовых противопожарных систем, использующих морскую воду составляет:
- из оцинкованной стали- 2 - 4 года
- из медноникелевого сплава- 5 - 7 лет.
Среди всех низкотемпературных хладоносителей хлорид кальция (ХК) имеет наибольшую коррозионную активность. Без введения противокоррозионных добавок ХК разрушает конструкционные стали со скоростью до 10 мм/год. Даже при введении концентратов противокоррозионных добавок согласно ТУ 2152-002-11490846-01, скорость коррозии конструкционных сталей, находящихся в контакте с 17% раствором ХК под атмосферным давлением, составляет 0,1…0,16 мм/год. Использование алюминия и ли меди снижает коррозию примерно в три раза, но значительно увеличивает затраты на создание системы.
Концентраты противокоррозионных добавок для хладоносителей на основе CaCl2 выпускаются по ТУ 2152-002-11490846-01. Их требуется вводить от 1 до 6 масс. % рассола, что также увеличивает затраты.
Итак, предложение использовать морскую воду или иные солевые растворы не может считаться эффективным и повышающим идеальность существующей системы уже на том основании, что пользователю придется регулярно полностью обновлять всю систему трубопроводов и обслуживающих систем.
Значимо для принятия решения еще и то, что ионы кальция препятствуют образованию пены (это может помешать использовать современное противопожарное оборудование).
Известно также, что вязкость солевого раствора повышается с уменьшением температуры. Данных о величинах вязкости для ХК при предельных минусовых температурах в литературе найти не удалось. Однако известно, что при снижении температуры с 0 до - 20 градусов по Цельсию, вязкость насыщенного раствора ХК увеличивается более чем в четыре раза - с 5 до 21 мПа ("О проблемах применения экосола и некоторых других хладоносителей в пищевой промышленности" Л. С. Генель, к. т. н., М. Л. Галкин, 000 "Спектропласт", (Москва) ("Холодильный бизнес" №1, 2002 г).
Из за увеличения вязкости работа в температурных зонах - 35 ...-45 градусов по Цельсию приведет к необходимости установки значительно более мощного насосного оборудования, чем это было необходимо при использовании обычной воды.
Вязкая жидкость распыляется менее эффективно. Потребуется проведение работ по настройке спринклерных систем.
7. Что будет после победы?
Но предположим, что все сложности удалось преодолеть.
Закупленный в больших количествах хлористый кальций в виде концентрированного раствора находится в специально переделанной под него системе пожаротушения. Зима, пожар на терриконе и система с блеском оправдывает понесенные ранее затраты, выливая на уголь десятки, сотни тонн раствора…
Оказывается, что тушение угля концентрированными растворами солей приведет к необходимости его последующей очистки или невозможности последующего использования по прямому назначению. Дело в том, что расплавы солей вызывают сильнейшую электрохимическую коррозию металлов, находящихся с ними в контакте. Хлористый кальций плавится при 772 градусах по Цельсию. В топке промышленной печи, котельной, такая температура - обычное дело. Следует сделать вывод о том, что одно из последствий внедрения предлагаемого способа тушения пожаров - ускорение прогара топок котлов, которые будут потреблять уголь, спасенный с помощью предложенной системы пожаротушения.
Итоги исследования:
Представляется, что решение, приведенное в статье вряд ли было реализовано заказчиком. Причин этому, как можно было увидеть из приведенных в Комментарии сведений, много. Достаточно очевидным является тот факт, что выбор в качестве незамерзающего наполнителя морской воды при температурах, которые бывают зимой в указанном регионе, не является удачным решением. В случае если это будет просто морская вода, при зимних температурах произойдет замерзание воды на стенках трубы с вытеснением насыщенного солью раствора к центру трубы, где затем произойдет, по достижении эвтектических температур, и его замерзание. Причем если система будет остывать медленно, в условиях, близких к равновесным, то оттеснение льдом раствора будет происходить медленно. При тонких трубах и резком похолодании, ледяная каша в виде пластинок может образоваться сразу по всему объему с последующим полным промерзанием. В обоих случаях система будет неработоспособна.
Если же в систему запустить раствор, где много соли, то на стенках трубопроводов будет выпадать соль.
Как стало ясно из вышеприведенного, лучшим вариантом из рассмотренных было бы иметь раствор эвтектического состава (который тоже, правда, замерзнет, при температурах порядка - 40 градусов).
Или, в предельном (домысленном нами случае) можно использовать концентрированный раствор хлористого кальция.
Для получения такого концентрированного раствора в воду потребуется добавить примерно в 10 раз больше солей, чем содержится в морской. Соли и замедлители коррозии необходимо закупать. Нужна обогреваемая система водоподготовки, состоящая, как минимум, из резервуара для воды с мешалкой и дозатором сыпучего вещества. Причем, если вспомнить, что эта система предназначена для тушения огромных угольных складов, то резервуар должен вмещать в себя десятки, если не сотни тонн воды. Для обычной заводской мешалки на такие объемы требуются десятки киловатт мощности. Нужны также мощные насосы, устройство для подачи соли со склада, соответствующий персонал, склад, транспорт и так далее. Кроме того, если даже предположить, что основная масса раствора не замерзнет в трубах, а выделит лишь незначительное количество солевого осадка или льда, то образование это произойдет сильнее всего по границе контакта труб с раствором, то есть по стенкам, форсункам, клапанам, вентилям, и так далее. Вероятность безаварийного срабатывания такой системы крайне низка. И если вентиль ото льда можно избавить прогревом, то соляной осадок нужно убирать промывкой. Учтем и коррозию системы, приводящую к необходимости ее регулярной полной замены. Завершают картину невозможность использования пенообразующих составов в сочетании с растворами солей и электрохимическая коррозия металла в случае попадания солей в топку вместе со спасенным углем.
Нет, видно не зря руководство порта хотело иметь устройство для подогрева воды.
P.S.:Мы готовы предоставить возможность высказаться по поводу этой задачи Алексею Васильевичу Подкатилину, представителям заказчика, внедрившего систему, всем желающим. Если будут представлены доказательства ошибочности наших замечаний и выводов, мы готовы принести всяческие извинения пострадавшей стороне.
Наш адрес: info@metodolog.ru.
Главная